統合ゲノム学分野は本学大学院医学系研究科において2020年1月より設置されました。
次世代プレシジョンメディシン開発講座は、がん遺伝子パネル検査・東大オンコパネル(Todai OncoPanel:TOP)のさらなる臨床応用を目指して、コニカミノルタ株式会社出資による社会連携講座として2021年4月に開講しました。
本講座における研究テーマの一部をご紹介いたします。
1)DNA-RNAツインパネルの臨床的有用性の検討
2)Cyclin E1高発現を標的とした卵巣がんの新規治療法の開発
3)GenMineTOPを用いたGermline Pathogenic Variantsの検出
※最近の研究実績一覧についてはこちら のページに掲載しております。
本研究では、東京大学が開発に携わり2023年に保険収載された日本初のDNA-RNAツインパネル検査であるGenMineTOPを対象としました。 この検査は、DNAパネルで737遺伝子、RNAパネルでは455遺伝子を解析し、体細胞変異やコピー数異常に加えて、融合遺伝子、エクソンスキッピング、RNA発現解析が可能です。 特にRNAパネルを有することで、融合遺伝子やエクソンスキッピングを効率的に検出出来ることが期待されますが、保険診療下のRNA解析を含めた検査の品質と、その臨床的有用性は十分に検証されていません。 そこで、本研究ではC-CAT(がんゲノム情報管理センター)のデータベースを活用し、実臨床における臨床的有用性を明らかにしました。
主な成果:
• 高い解析成功率と品質の頑健性
DNAパネルは98.5%、RNAパネルは97.1%の症例で品質基準を満たしていました。 サンプル採取から検査までの時間が長いほど成功率は低下する傾向にありましたが、 5年以上保存された検体でもRNAパネルでは92.9%が解析可能であり、 長期保存検体に対するRNAパネルの頑健性が示されました(表1)。
表1 品質基準を満たした症例の割合

• ゲノム異常の検出率
1,356例中91.5%で、臨床的意義を有する遺伝子異常(体細胞変異、コピー数増幅、融合、エクソンスキッピング)を検出しました。 DNAパネルでは解析対象遺伝子数が多いことを反映し、国内の他検査では解析対象外となるKMT2C(n=28)、ARID1B(n=24)の病的変異を比較的高頻度に検出しました。
• RNAパネルの臨床的有用性
RNAパネルにより105の融合遺伝子、13のエクソンスキッピングを検出しました。 特に分子標的薬が保険診療で承認されているNTRK融合遺伝子は全症例中11例(0.8%)で陽性でした。 既存のDNAパネル検査で解析されたC-CATの症例の中から、今回の1,356例と年齢およびがん種を一致させた症例をランダムに抽出し、 NTRK融合遺伝子陽性率を10,000回シミュレーションしたところ、陽性率の中央値は0.44%(95%信頼区間 0.147–0.739%)となり(図1)、 GenMineTOPによる陽性率が高い可能性が示唆されました。 さらに、診断上有用な融合遺伝子は49例で検出され、特に肉腫を中心に診断的価値の高いゲノム異常が多く認められました。
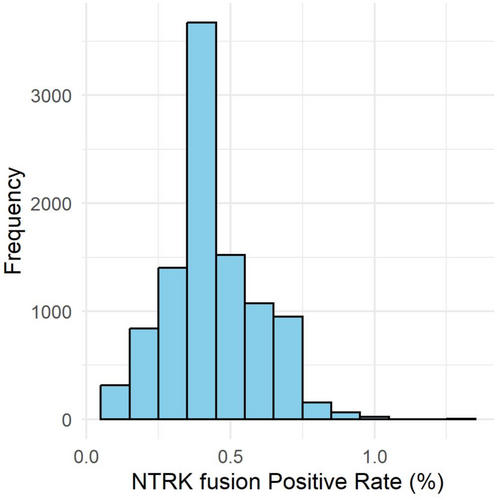
図1 既存のDNAパネル検査でのNTRK融合遺伝子陽性率のシミュレーション
• RNA発現量の解析
コピー数とRNA発現量の解析では、MDM2、CDK4、EGFR、ERBB2で強い相関がみられた一方で、MYCやFGFR1では弱く、 遺伝子増幅の解釈に注意が必要と考えられました。 さらに、がん種による発現量の差や、KIT変異、TERTプロモーター変異、融合遺伝子と発現量増加との関連も確認されました。
意義と将来展望:
本研究により、日本発のDNA–RNAツインパネル検査が、実臨床においても高い解析成功率を維持できること、 さらに融合遺伝子やスプライス異常を高感度に検出できることが示されました。 RNA解析の強みとして、DNA解析では検出が困難な融合遺伝子やエクソンスキッピングを直接検出できる点に加え、 解析対象遺伝子数が多いことから、多様な融合遺伝子を検出できる可能性が高まることが期待されます。 遺伝子発現量については現時点では27遺伝子のみが報告対象であり、高発現・低発現を判定するためのカットオフ値も確立されていないため、 臨床的有用性は限定的です。 引き続き、遺伝子発現量も含めたゲノム情報の活用法を研究・開発し、より精密ながんゲノム診断と個別化医療の実現を目指します。
Watanabe K, Ogawa M, Shinozaki-Ushiku A, Tsutsumi S, Tatsuno K, Aburatani H, Kage H, Oda K. Real-World Data Analysis of Genomic Alterations Detected by a Dual DNA-RNA Comprehensive Genomic Profiling Test.
Cancer Sci.
2025;116(7):1984–1995.
doi:10.1111/cas.70071
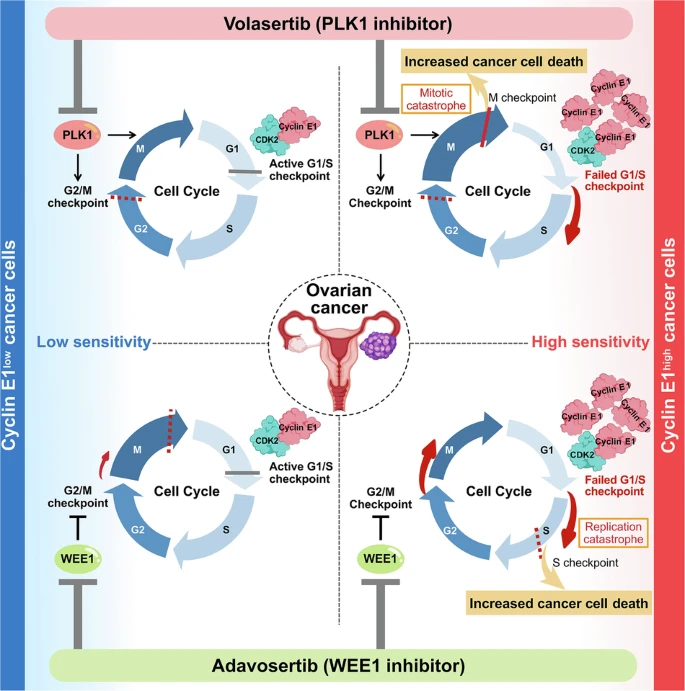
卵巣がんは治療抵抗性と再発率の高さから、依然として治療困難ながん種のひとつです。Cyclin E1の過剰発現は、高異型度漿液性癌や明細胞癌において約20%の頻度で認められ、プラチナ製剤やPARP阻害薬が効きにくい相同組み換え修復(HR; Homologous Recombination Repair)機構が保たれた腫瘍(HR-proficient腫瘍)に多くみられます。こうした腫瘍は予後不良であり、新たな治療標的の探索が求められています。
当研究室では、細胞周期制御に関わるPLK1およびWEE1という2つのキナーゼに着目し、Cyclin E1の発現レベルによってこれらの阻害剤の効果が変動することを明らかにしました。
主な成果:
•
Cyclin E1を高発現する卵巣がん細胞では、PLK1阻害剤(volasertib)およびWEE1阻害剤(adavosertib)に対する感受性が有意に高く、細胞死(アポトーシス)や細胞周期停止を誘導
•
Cyclin E1を人為的に発現抑制または過剰発現させると、これら薬剤の効果もそれに応じて変化
•
TP53変異の有無は薬剤感受性に影響を与えず、Cyclin E1の発現がPLK1およびWEE1阻害剤の有効性を予測する有効性を予測するバイオマーカーである可能性が示されました。
•
マウスモデルにおいても、Cyclin E1高発現腫瘍において腫瘍縮小効果を確認
意義と将来展望:
Cyclin E1高発現は、従来の治療が効きにくいHR-proficient卵巣がんにおいて、PLK1阻害剤やWee1阻害剤の有効性を予測するバイオマーカーとなる可能性が示されました。本研究は、PLK1阻害剤やWEE1阻害剤による個別化治療(Precision Medicine)の実現に貢献すると期待されます。今後は、これらの阻害剤の併用療法など、多角的な治療戦略の確立に取り組みます。
Xi Q, Kunita A, Ogawa M, Ka M, Tanimoto S, Tsuchimochi S, Nagai S, Matsunaga A, Fukuda T, Watanabe K, Sone K, Shinozaki-Ushiku A, Kawana K, Ushiku T, Osuga Y, Katayama K, Kage H, Oda K.Cyclin E1 overexpression sensitizes ovarian cancer cells to WEE1 and PLK1 inhibition.
Oncogene
44, 1375–1386 (2025).
doi:10.1038/s41388-025-03312-4
日本では、固形がん患者を対象としたがんゲノムプロファイリング(CGP)検査と呼ばれる遺伝子関連検査が保険診療として行われています。多くは「腫瘍のみ」を解析する検査ですが、この方法では「がん細胞だけに起こっている変化(体細胞変異)」と「生まれつき持っている変化(生殖細胞系列病的バリアント:Germline Pathogenic Variants, GPVs)」すなわち遺伝性腫瘍症候群か否かを区別できません。このため、遺伝性腫瘍症候群が疑われる変化(Presumed GPVs, PGPVs)が見つかった場合は、本当に生殖細胞系列の変化かを確認するため血液などを用いた
確認検査
が必要です。しかし腫瘍組織のみのCGPの結果を踏まえて確認検査を受ける患者は約3程度にとどまっています(Shimada S et al. J Hum Genet. 2025)。遺伝性腫瘍症候群の診断がつけば、本人だけでなく血縁者のがん予防や早期発見のための適切な管理(リスク管理)が可能になります。
この課題を解決するうえで、腫瘍と正常組織を同時に解析する「腫瘍/正常ペア解析(マッチドペア解析)」の有用性が考えられます。2023年8月に保険適用されたGenMineTOPは、この解析を採用し40遺伝子(2024年10月以降は59遺伝子)でGPVsを検出できる検査です。 本研究では、C-CAT(がんゲノム情報管理センター)のデータベースに登録された全国データを活用して、保険適用から1年間で得られたデータを解析しGPVsの特徴を明らかにすることを目的としました。
主な成果
:
• 検出率
:1,356名の固形がん患者にGenMineTOPを行い、5.4%でGPVsを検出しました。
• がん種分布
:卵巣、乳腺、膵臓に加え、軟部組織、中枢神経(脳)、胆道、末梢神経のがんでもGPVsが3%以上の頻度で検出されました。
• Off-tumorでの検出
:38.2%は「その遺伝子とがん種の関連がまだ知られていない腫瘍(Off-tumor)で検出されました。特にBRCA1/2以外のDNA修復関連遺伝子(ATM, RAD51Dなど)は、75%がOff-tumorで検出されました(図1)。
• 高齢者での検出:65歳以上の男性
においても多くのGPVsが検出され、高齢者での診断の重要性が示唆されました(図2)。
•
GenMineTOPにより、RAD51D、BRIP1、SDHB、CDH1など、本邦におけるマッチドペアCGP検査の中で初めて搭載された遺伝子におけるGPVsが検出され、遺伝性腫瘍症候群の早期発見に貢献しました。
図1. 遺伝性腫瘍別のOn-tumor(関連がん)/Off-tumor(非関連がん)分布
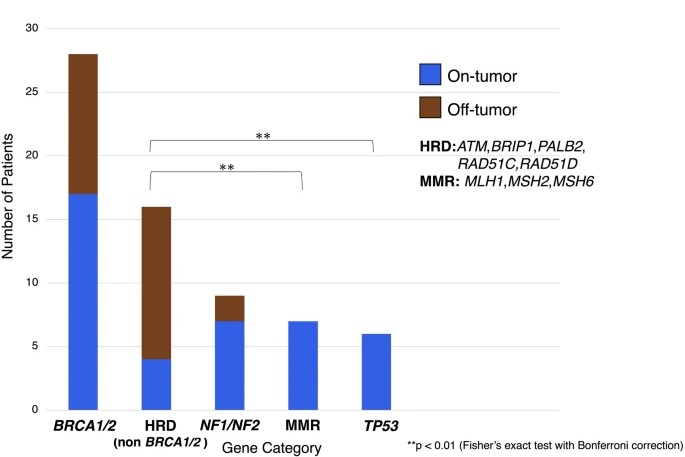
図2. 遺伝性腫瘍および男女別の年齢分布
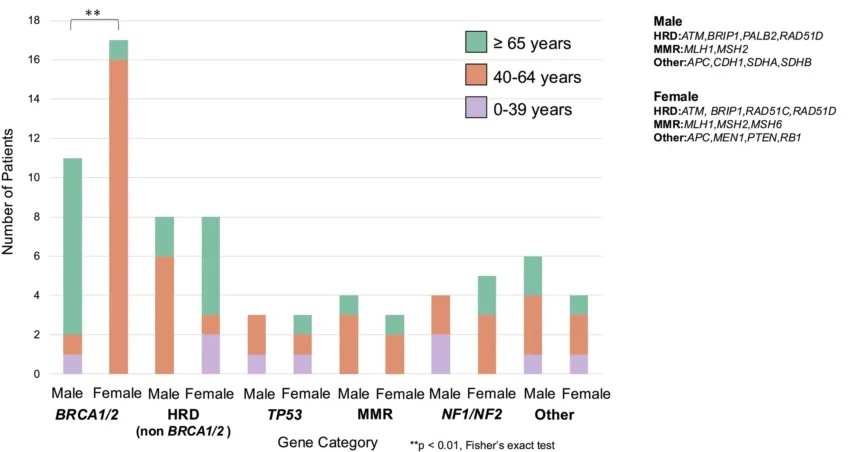
GPVsが検出された男性患者の57.9%が65歳以上
であり、特にHR関連遺伝子(ATM、BRCA1、BRCA2など)では顕著でした。
意義と将来展望:
GenMineTOPにおける腫瘍/正常ペア解析を通じて、遺伝性腫瘍の診断を受けられる方が増えることが期待されます。特に、Off-tumorの患者で検出された所見も多く、今後はこれらのGPVsが実際に発がんに関連しているのかを解明していく必要があります。加えて、GenMineTOPでは、2024年10月からGPVs報告対象遺伝子が59遺伝子に拡張され、より広範囲な遺伝性腫瘍症候群への対応が可能になりました。新たに追加された遺伝子を含め、遺伝性腫瘍症候群の早期発見や治療法の確立に向けた研究を進め、患者個々に最適な治療を提供できるよう取り組んでいきます。
血液検査により遺伝性腫瘍症候群か否かを診断する遺伝学的検査として、多遺伝子パネル検査(生殖細胞系列バリアントのみを調べる検査)が日本でも普及していますが、保険適用となっていないために検査を受けられない方が多くいらっしゃるのが実情です。GenMineTOPを含むCGP検査は遺伝学的検査と同一の解析手法ではないため検出しきれない構造異常などがあることに注意が必要ですが、GenMineTOPで得られた情報を有効に用いることで、これまで診断に至らなかった
遺伝性腫瘍症候群の診断につながり、ご家族への予防医療(がんの発症予防や早期発見)に寄与することが期待されます
。 また、従来の「遺伝子変異と発がんとの関連が低い」とされていたがん種でもGPVsが見つかるという新しい知見から、「どのような患者にどのような遺伝子検査を提供すべきか」という臨床的な指針の見直しにも貢献します。 今後は、
新たに見つかったGPVsが本当にがんの発症に関わっているのか
、またそのような患者にどのような治療や予防策が適切なのか?といった点を明らかにしていく予定です。 私たちの研究室では、患者一人ひとりに合わせたより正確な診断と最適な治療”を目指して、がんのゲノム研究を推進しています。
Habano E, Ogawa M, Watanabe K, Akiyama N, Chang H, Ka M, Shinozaki-Ushiku A, Tanabe M, Akahori M, Ichijo T, Tsutsumi S, Tatsuno K, Aburatani H, Kage H, Oda K. Germline Pathogenic Variants Detected by GenMineTOP: Insight from a Nationwide tumor/normal Paired comprehensive genomic profiling test, in Japan.
J Hum Genet.
doi:10.1038/s10038-025-01389-z
大学院生の募集/研究室の見学について
当講座では大学院生を募集しています。詳細はこちら のページをご覧ください。
スタッフ
| 名前 |
役職 |
専門領域 |
| 織田 克利 |
教授 |
産婦人科学、ゲノム学 |
| 渡邊 広祐 |
特任准教授 |
呼吸器内科、臨床検査医学、がんゲノム医療 |
| 国田 朱子 |
特任講師 |
分子生物学、分子腫瘍学 |
| 小川 弥穂 |
特任助教 |
血液がん、Liquid Biopsy |

 TOP
TOP